|
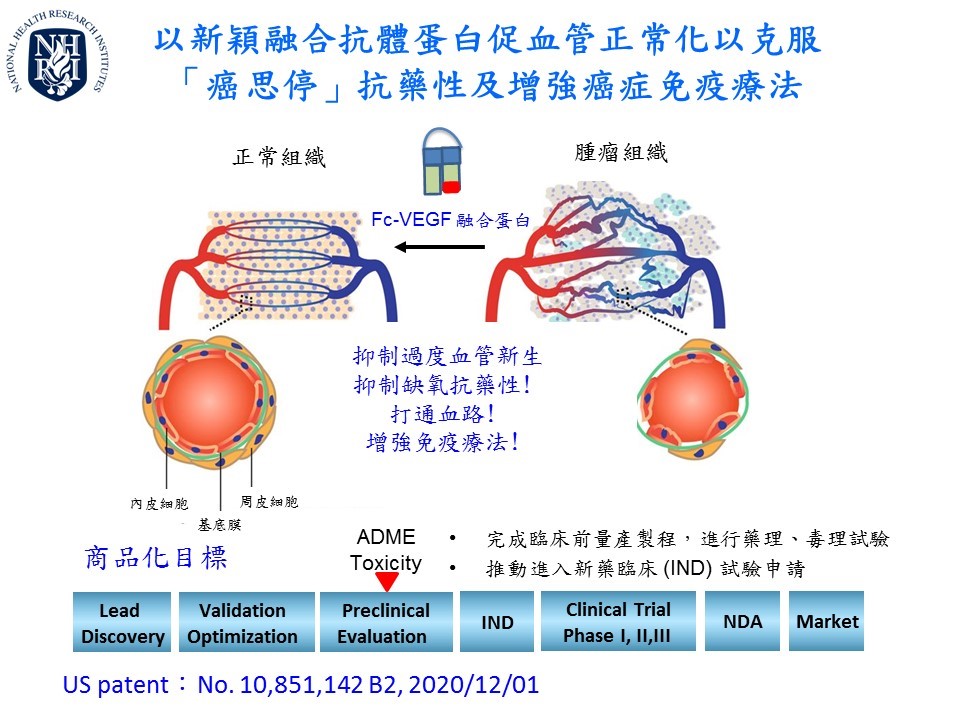
抗腫瘤血管新生是過往發展抗癌藥物的重要方向之一,然而研究發現腫瘤微環境會因缺氧出現代償作用,反而促進癌症轉移。以血管正常化為思維研發之全新融合抗體蛋白藥物,則可藉低劑量抑制過度血管新生、減少巨噬細胞極化…… |
| 國家衛生研究院癌症研究所 李岳倫研究員團隊 |
近年來,免疫療法的臨床應用讓癌症治療出現一道曙光,然而,免疫療法的成效受腫瘤微環境左右。當癌細胞誘發慢性發炎反應、雜亂增生的血管與極化的巨噬細胞抑制了免疫反應,也讓癌細胞逃避免疫監控,使免疫檢查點抑制劑對實體腫瘤的有效反應率只有20~30%,因此腫瘤微環境狀態將是免疫治療成功的重要關鍵! ▌有效抑制腫瘤生長、強化anti-PD-L1療效 癌症血管新生是癌細胞因應缺乏養分、缺氧等壓力所發展出來的一種生長策略。腫瘤新生血管結構多扭曲且粗糙佈滿孔隙,極不利於藥物輸送與免疫細胞的浸潤。因此,抗血管新生就一直是發展抗癌藥物的重要方向之一。然而,抗血管新生藥物卻對癌症病人沒有很大的助益,原因是當這些抗血管新生藥物完全抑制血管生成後,很快因嚴重缺氧出現嚴重抗藥性,腫瘤微環境出現代償作用以及發炎反應,反而促進癌症轉移造成病人死亡。因此,團隊以「血管正常化」的思維研發Fc-VEGF全新融合抗體蛋白藥物,藉由合適的低劑量抑制過度腫瘤血管增生,促使腫瘤內原本絮亂無章的血管變為較正常。透過動物實驗證實Fc-VEGF融合蛋白抑制腫瘤過度血管新生、抑制癌細胞缺氧代償作用(HIF-1α路徑) 克服抗藥性、減少腫瘤微環境內巨噬細胞極化成促腫瘤生長的M2巨噬細胞、並減少分泌VEGF-A、IL-6、TGF-β,改善免疫抑制的腫瘤微環境。實驗進一步證實,Fc-VEGF融合蛋白可促使腫瘤內原本絮亂無章的血管變為較正常,且增加腫瘤微環境中殺手T細胞與自然殺手(NK)細胞的浸潤,在與免疫檢查點抑制劑anti-PD-L1的合併治療實驗中,可更加有效抑制腫瘤生長,讓anti-PD-L1的治療效果更加顯著。 ▌可以傳統蛋白純化方式製成、保存容易 Fc-VEGF融合蛋白藥物目前已完成動物有效性試驗與初步的動物安全性試驗。Fc-VEGF融合蛋白可在人類細胞 293T中大量表現,並且可利用傳統蛋白純化的方式或快速蛋白質液相層析系統(FPLC) 將其純化並且保存在-20度的環境中超過一年的時間。專利佈局方面,已獲得美國(US patent No. 10,851,142 B2)、日本、及歐盟的專利保護。團隊預計於2023年提出美國與台灣臨床新藥試驗 (IND)申請,提供癌症患者一個搭配其他免疫療法的極佳組合治療的選擇。
▌技術強項與優勢 1. 創新性: 2. 安全性: 3. 成本低: 4. 市場性:
|
|
▌開放那些合作項目?
|
|||
Copyright © 2012 - 2025 Research Center for Biotechnology and Medicine Policy (RBMP). All Rights Reserved