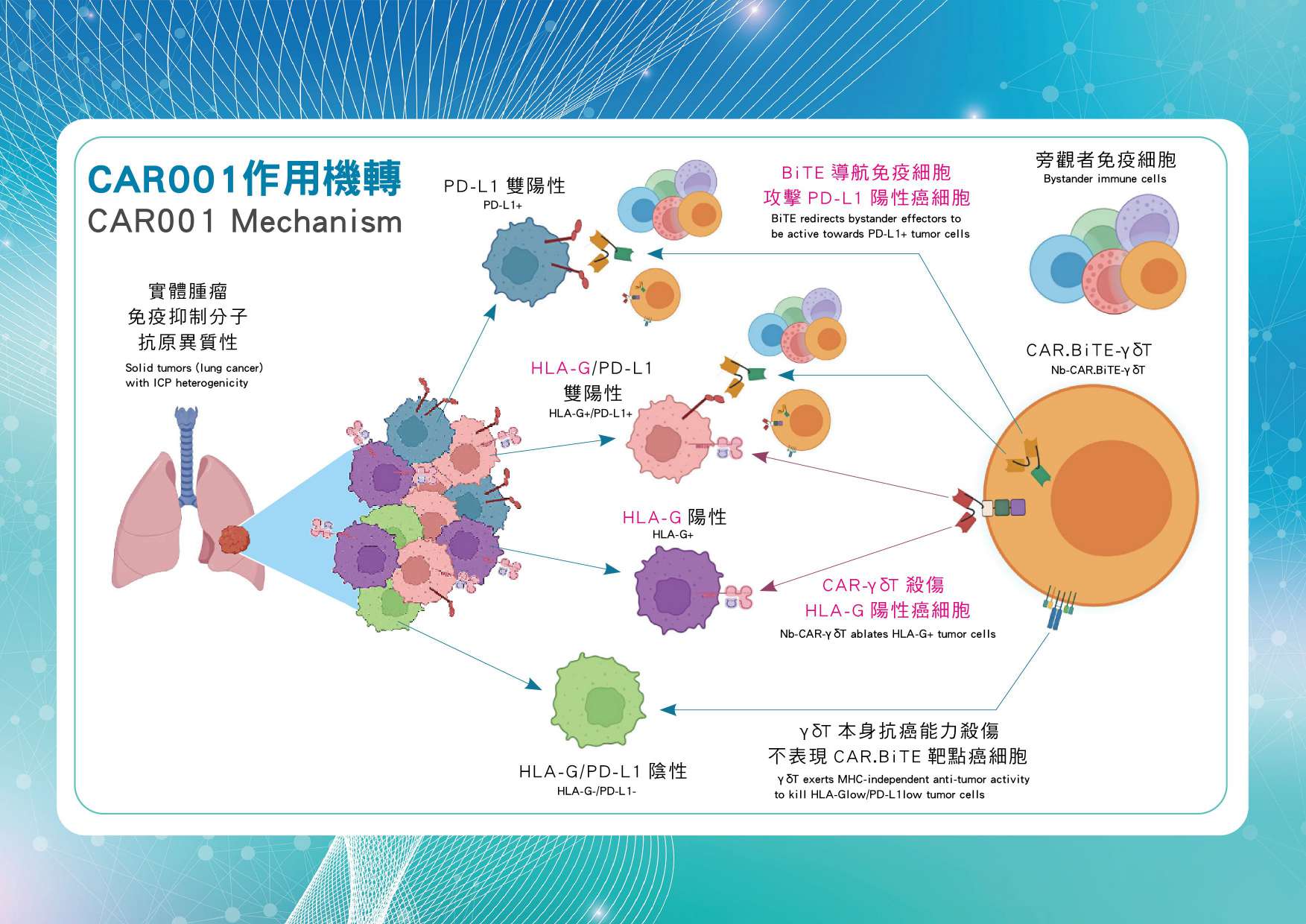
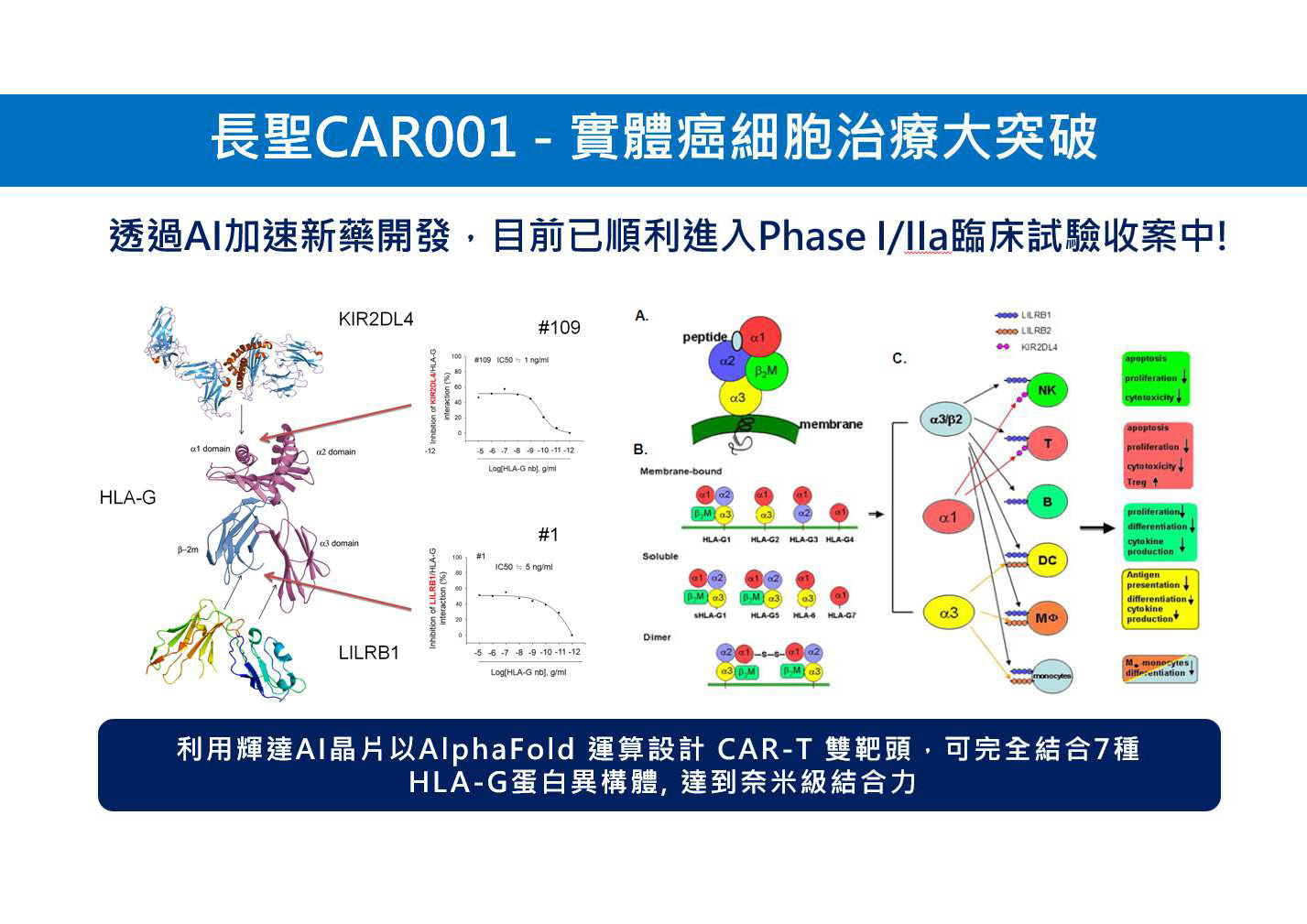
CAR001-實體癌細胞治療大突破 目前已上市的CAR-T療法主要針對血液腫瘤,尚未能有效治療實體腫瘤,而且需要使用病患自體免疫細胞進行改造,這過程需客製化、耗時需約1-2個月,單一療程就要價40萬美金(換算台幣1,200萬)。 長聖為了解決這些限制,開發了以異體細胞療法治療實體癌的CAR001。這款新藥使用健康人提供的細胞,品質穩定且不需客製化,能夠像一般藥品大規模生產並降低成本,且癌末病患不需等待便可立即使用,爭取癌末病患治療機會。 CAR001是全球首例同時具備CAR嵌合抗原受體T細胞並以HLA-G為靶點,能精準毒殺實體腫瘤,還具有雙特異性抗體細胞療(BiTE),能同時招集旁觀者效應T細胞共同對抗腫瘤。這意味著CAR001不僅能直接攻擊實體腫瘤細胞,還能叫來其他免疫細胞一起幫忙攻擊腫瘤。值得注意的是,與已上市的CAR-T療法不同,CAR001利用訊息RNA(mRNA)進行基因修飾,能降低突變風險。 長聖的研發團隊利用AI技術進行HLA-G靶點篩選,並設計和優化蛋白質結構,使CAR001能優先與實體腫瘤上的HLA-G靶點結合,能有效克服實體腫瘤的免疫抑制效果。CAR001在實體腫瘤動物模型已有很好效果,能消滅近九成的實體腫瘤,研究成果已發表在國際頂尖期刊《Advanced Science》。
2.在腫瘤動物模型能消滅近九成的實體腫瘤,研究成果已發表在國際期刊Advanced Science。
3.取得US FDA與TFDA核准執行Phase I/IIa臨床試驗,並已開始招募受試者。
4.公司規模完備,研發團隊能力優異,有良好的平台可以支持新技術與新應用的開發。

力拼CAR001為台灣首家取得異體CAR-T再生醫療藥證
長聖為全球第一家透過AI篩選出HLA-G靶點的CAR-T技術,異體CAR001新藥已獲得台灣與美國FDA核准進行Phase I/IIa臨床試驗,且榮獲醫藥品查驗中心(CDE)指標案件輔導,已開始進行大腸直腸癌、惡性腦癌、三陰性乳癌和非小細胞肺癌等受試者臨床試驗招募。
CAR001 為異體細胞可大量生產製造 “Off-the-shelf”隨取隨用及降低成本的優勢下,使 CAR001 價格將會更親民與降低政府負擔。長聖積極進行CAR001 臨床試驗,根據《再生醫療製劑條例》,對於危急生命或嚴重失能疾病,未來完成二期臨床試驗並具有全性與初步療效,將力拼首家以異體CAR-T 治療實體癌再生醫療製劑業者,並且將規劃申請全民健康保險。依據最新衛生福利部110年癌症登記報告,新發生癌症人數為12 萬1, 762 人,若CAR001開發成功上市,將有助於減輕我國政府和民眾的負擔,為無數癌末患者帶來生機。
Copyright © 2012 - 2025 Research Center for Biotechnology and Medicine Policy (RBMP). All Rights Reserved