企業新創 - 生技製藥與精準醫療
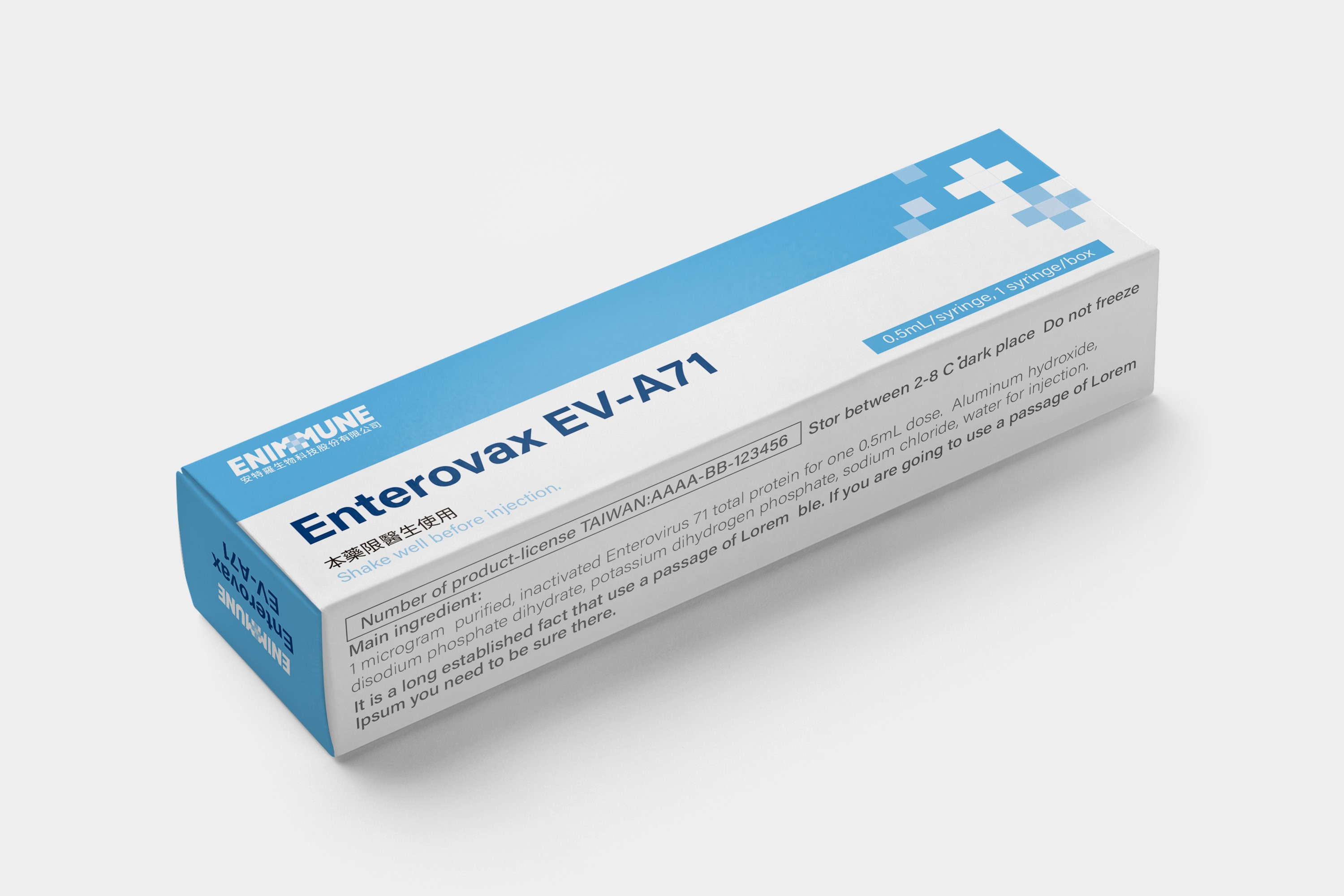
安拓伏腸病毒71型疫苗
2024-01-03
安特羅生物科技股份有限公司
「安拓伏腸病毒71型疫苗」為台灣第一個人用疫苗完全由本土自行研發、歷經制程開發、臨床開發及完成新藥查驗登記核可領證後總計13年上市,以無血清細胞培養,搭配高規格之生物反應器進行生產,具高安全性、高品質及高產能等優勢,可保護孩童免於高致命性腸病毒的威脅,於今(2023)年取得台灣許可藥證(衛部菌疫製字第000149號)。安特羅生技獨立完成新藥商業化的所有階段,驗證臺灣自研發到量產疫苗專業能力之提升,極具指標意義。同時佈局海外市場,已於越南執行臨床三期試驗,並將開展中國臨床試驗。
評審推薦
1. 「安拓伏腸病毒 71 型疫苗」適用年齡為2個月至未滿六歲嬰幼兒,僅需接種兩劑,間隔28天。臨床三期試驗血清保護率高達98.31%,預期對腸病毒導致疾病的保護率達到90%以上。已於2023年2月取得衛生福利部藥品許可證(衛部菌疫製字第 000149 號)。
2. 涵蓋腸病毒感染併發重症的高危險年齡層,可大幅降低腸病毒71型感染併發重症產生的醫療及社會成本。
3. 採生物反應器結合無血清細胞培養相關技術生產,為產量高、效率高、交叉汙染低的生產平台,符合 PIC/S GMP 規範,具競爭力。
4. 安特羅生物科技股份有限公司與國光生技公司共同開發建立生物反應器平台之商業量產製程技術可應用到其他疫苗產品製程開發,是台灣疫苗生技產業重要的發展。
2. 涵蓋腸病毒感染併發重症的高危險年齡層,可大幅降低腸病毒71型感染併發重症產生的醫療及社會成本。
3. 採生物反應器結合無血清細胞培養相關技術生產,為產量高、效率高、交叉汙染低的生產平台,符合 PIC/S GMP 規範,具競爭力。
4. 安特羅生物科技股份有限公司與國光生技公司共同開發建立生物反應器平台之商業量產製程技術可應用到其他疫苗產品製程開發,是台灣疫苗生技產業重要的發展。
公司簡介
「安特羅生物科技股份有限公司」為人用新藥開發公司,其營運主軸為新藥臨床試驗、藥證申請、通路行銷等業務,與高潛力研發型公司協同合作,力推新藥商品化,在生技產業鏈中不僅風險較小且具創新性,透過上中下游的聯盟合作將產業鏈資源有效分配,能更有效率地上市新藥。我們以愛為出發點,關心人群的健康,注重預防與治療,為了讓人們免於疾病威脅,聚焦各式傳染病防治,希望藉由新藥的加速發展,讓所有人都活得健康、活得有品質。
本網站中所有資料(包括影音.文字.圖表.數據等) ,均屬於本中心或各該新創企業團隊之專屬財產,如有引用,請確實註明出處來源。
<完整資訊>
財團法人生技醫療科技政策研究中心 版權所有
Copyright © 2012 - 2025 Research Center for Biotechnology and Medicine Policy (RBMP). All Rights Reserved
Copyright © 2012 - 2025 Research Center for Biotechnology and Medicine Policy (RBMP). All Rights Reserved