|
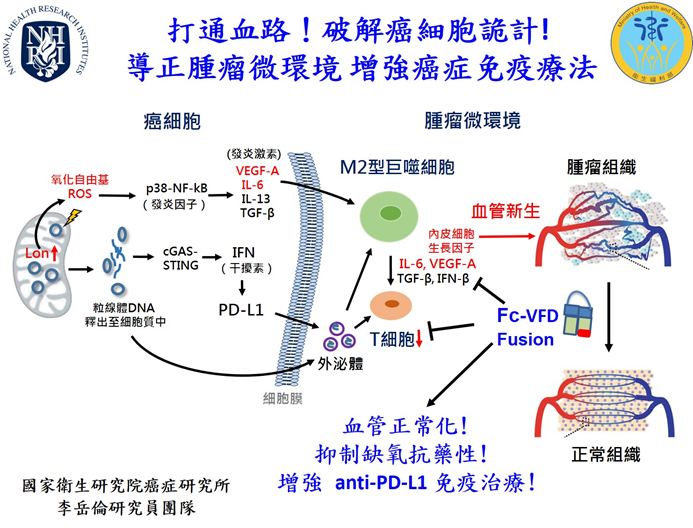
實體腫瘤免疫療法的成效深受腫瘤微環境狀態左右。腫瘤微環境能讓癌細胞逃避免疫細胞監控,因此腫瘤微環境狀態就是免疫療法成功的關鍵。國衛院李岳倫研究員團隊以「血管正常化」的思維來解決目前免疫治療所遇到的困境,創新研發融合抗體蛋白藥物,透過此藥物能夠增強免疫治療效果... |
|
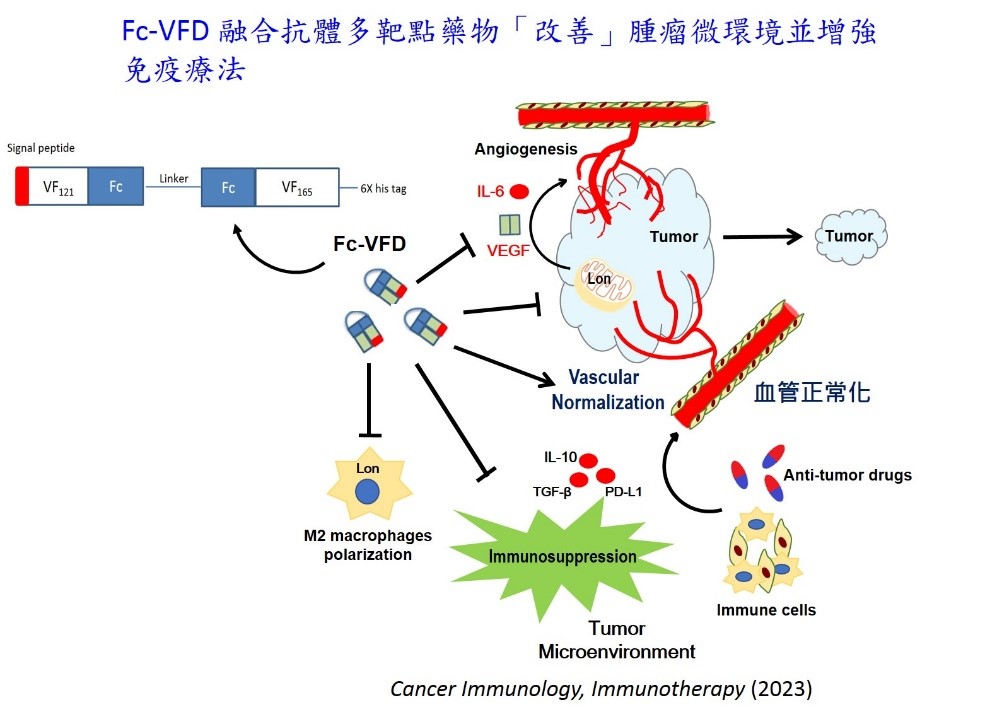
根據世界衛生組織 (WHO) 的數據,估計到2030年,全球癌症新發生人口將增加至2580萬,比2018年增加37%。近年因免疫療法的出現,讓癌症治療出現一道新曙光;然而,實體腫瘤免疫療法的成效卻深受腫瘤微環境狀態左右。當微環境誘發慢性發炎反應、加上雜亂扭曲增生的血管與缺氧抑制了免疫反應,讓癌細胞逃避免疫細胞監控,使得免疫檢查點抑制劑的有效反應率只有20~30%,因此腫瘤微環境狀態就是免疫療法成功的關鍵。國衛院李岳倫研究員團隊以「血管正常化」的思維來解決目前免疫治療所遇到的困境,利用血管生長因子 (Vascular Endothelial Growth Factor A, VEGF-A) 創新研發融合抗體蛋白藥物,透過此藥物能夠增加免疫細胞浸潤以增強免疫治療效果。 以中醫治癌思維發想!推動腫瘤「血管正常化」成為團隊核心理念解決缺氧抗藥性 目前臨床有抑制血管新生的抗癌藥物 - 癌思停 (Avastin/Bevacizumab),儘管初期能有效阻斷腫瘤從循環系統得到氧氣、養分,但也阻斷免疫細胞浸潤的管道。而到治療後期,因為腫瘤出現嚴重缺氧,不斷地刺激缺氧誘導因子(HIF-1α)的訊息傳導,讓腫瘤開始產生抗藥性,促進癌症轉移,而加速死亡。因此,國衛院李岳倫研究員團隊受中醫治癌思維”活血祛瘀、舒利通絡”概念的啟發,以「血管正常化」為設計概念,結合以基因遺傳工程改造的血管內皮細胞生長因子(VEGF-A),以及抗體的Fc區域,共同組成全新的Fc-VEGF融合抗體蛋白 (Fc-VFD)。此融合抗體藥物不但抑制過度腫瘤血管增生與腫瘤生長,也促使腫瘤內原本絮亂無章的血管變為較正常,導正腫瘤微環境。而且增加抗體區域設計,還可藉由免疫細胞表面的Fc接受器來活化免疫細胞,以增強癌症免疫療法的成效。因此,Fc-VFD融合抗體可透過避免過度缺氧的抗藥性問題、以及以「血管正常化」與改善腫瘤微環境增強癌症免疫療法的效果。
基因重組建構融合抗體蛋白競爭血管生長因子受體有效促進血管正常化 在血管新生時,必須透過VEGF-A形成二聚體 (homodimer),然後二聚體再與受體VEGFR1/2 結合,才能活化下游的訊號傳遞。因此,我們在六種 VEGF-A異構物 (isoforms) 中,透過基因重組建構的方式,測試挑選出VEGF121及VEGF165的兩個單體,每個單體分別連結一段抗體重鏈內的固定區: Fc (Fragment crystallizable region),然後再連接兩單體成VEGF121-VEGF165融合抗體雙體蛋白質。 加入抗體的Fc區域,不僅可增強二聚體形成利於結合受體,而且使得蛋白半衰期在體內更長、更穩定,還可結合免疫細胞而增強其活性。比起正常VEGF165二聚體,由於融合抗體雙體之VEGF121缺乏受體結合功能的區域,更易形成二聚體、且更易結合VEGFR2受體,故能以極低濃度的劑量抑制過度血管新生、抑制癌細胞的增殖、侵襲,達到「血管正常化」的目的。
※系列報導: |
| ※本文由生策中心新創幫編輯群採訪撰寫(口述:國衛院李岳倫研究員團隊 執筆:陳柏翔)。如有引用,請確實註明出處來源。 |
Copyright © 2012 - 2024 Research Center for Biotechnology and Medicine Policy (RBMP). All Rights Reserved