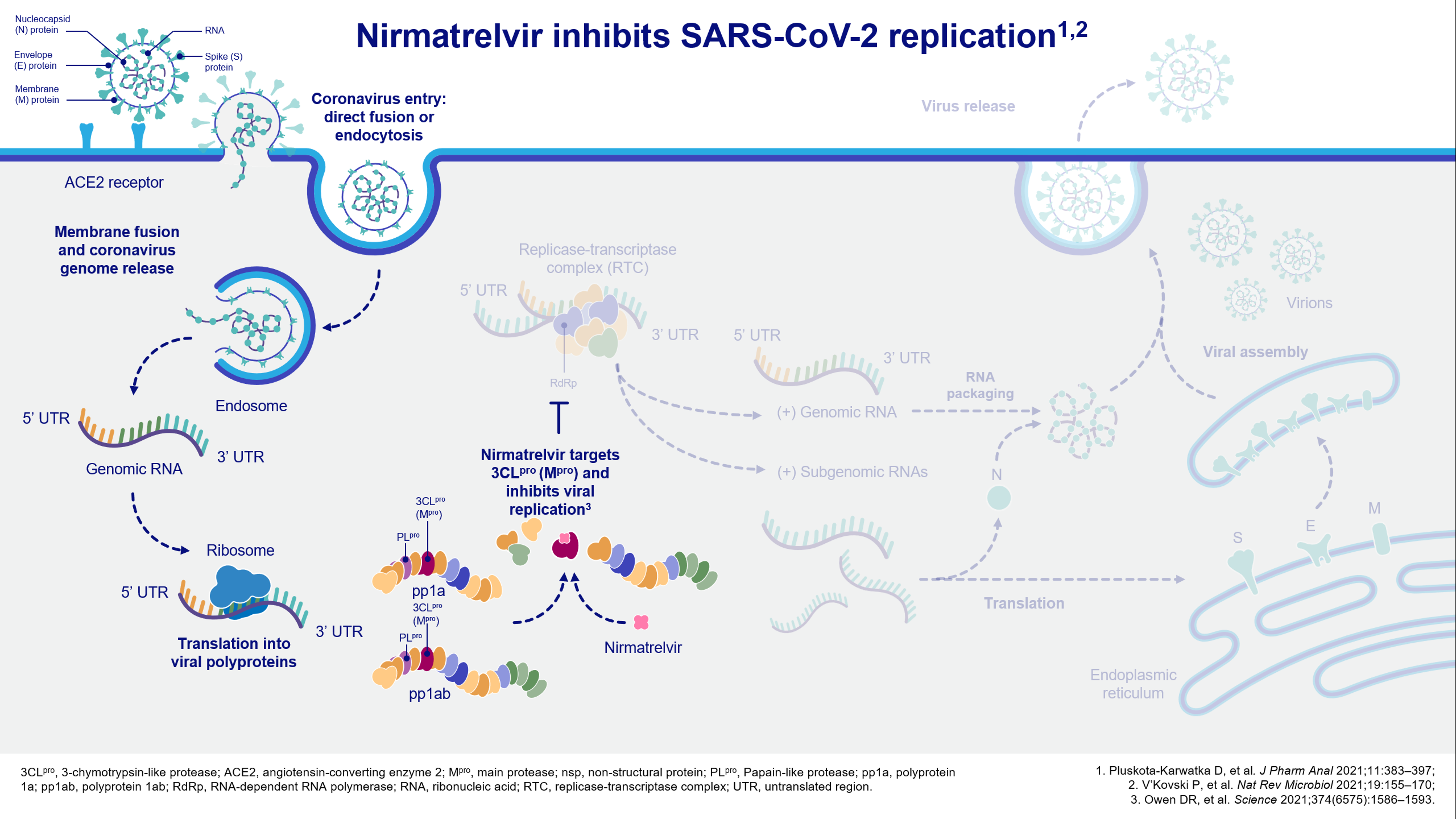
WHO統計至2023年8月9日,全球新冠肺炎確診人數約為7.7億人,約690萬人死於此疾病。截至同日,台灣約1213萬人確診,累計死亡超過2萬人。SARS-CoV-2冠狀病毒患者症狀不易與其他感染分辨,約有14%出現嚴重症狀需住院與氧氣治療,5%需加護治療。雖COVID-19疫苗證實能在預防重症、住院和死亡上發揮顯著的功用,但因病毒不斷變異,疫苗預防感染的有效性降低許多。因此,患者迫切需要有效的治療藥物,於病毒感染初期及早介入治療以避免後續惡化。肺炎住院的重症病患中,疾病致死率可高達八成五。根據新型冠狀病毒感染臨床處置指引,目前有實證支持的重症風險因子包括年齡≧65 歲、氣喘、癌症、糖尿病、心血管疾病、慢性肺疾等14類高風險族群。EPIC-HR試驗的分析結果與安慰劑相比,PAXLOVID對於上述高風險族群於28天內發生因COVID-19相關原因住院或任何原因導致死亡風險相對降低88.9%。依據試驗結果,2021年12月22日美國FDA即迅速通過緊急授權使用(EUA)核准PAXLOVID用於治療具風險因子之輕至中度確診患者。台灣衛生福利部亦於2022年1月15日同意PAXLOVID (倍拉維)專案輸入使用於發病5天內、具有重症風險因子之成人與兒童病人(12歲以上且體重至少40公斤)的輕度至中度新型冠狀病毒疾病確診者。至此,因其口服藥的方便性、優異的實際臨床療效及安全性等優點,台灣食藥署於2023年6月28日授予正式藥證,為此類病患帶來劃時代的治療選擇。
2. PAXLOVID 於2021年12 月22 日通過美國FDA 緊急授權使用(EUA),用於治療具風險因子之輕至中度確診患者。台灣衛福部亦於2022 年1 月15 日同意倍拉維專案輸入使用,並於2023年6月28日授予正式藥證。
3. PAXLOVID 為重要治療COVID疾病之藥物,具市場競爭力。

輝瑞藥廠(Pfizer Inc.)成立於1849年,總部設於美國紐約,產品行銷遍及世界各地,是全球頂尖的創新生物製藥公司。1962年,輝瑞在台灣設立分公司,是國內第一家獲准設立的外商藥廠。「持續創新以改變病患生命」是我們的企業願景,並以「勇氣、卓越、平等與喜悅」四個價值觀勾勒出輝瑞文化,做為公司發展基石。
科技不僅改變我們的生活,也掀起人類保健革命。輝瑞結合促進轉型的技術與尖端科學,成為生物製藥創新的先驅,不僅治療棘手的疾病,更能治癒或預防這類疾病。輝瑞每日努力開發各種改變病患生命的創新發明,開啟醫療可能性的新世界。我們也展現智能與熱情,以確保人人皆可獲得這些創新的治療。輝瑞讓科學與科技發揮更大的力量,同時展現更大的勇氣與進行更深入的探索,讓過去無法想像的事物化為現實。
Copyright © 2012 - 2024 Research Center for Biotechnology and Medicine Policy (RBMP). All Rights Reserved